W trakcie reakcji PCR często napotykane są pewne czynniki zakłócające.
Ze względu na bardzo wysoką czułość metody PCR, zanieczyszczenie jest uważane za jeden z najważniejszych czynników wpływających na wyniki PCR i może powodować fałszywie dodatnie wyniki.
Równie istotne są różne źródła wyników fałszywie ujemnych. Jeśli jeden lub więcej istotnych składników mieszaniny PCR lub sama reakcja amplifikacji zostaną zahamowane lub zakłócone, test diagnostyczny może zostać utrudniony. Może to prowadzić do obniżenia wydajności, a nawet do wyników fałszywie ujemnych.
Oprócz zahamowania, utrata integralności docelowego kwasu nukleinowego może nastąpić z powodu warunków transportu i/lub przechowywania przed przygotowaniem próbki. W szczególności wysokie temperatury lub niewłaściwe przechowywanie mogą prowadzić do uszkodzenia komórek i kwasów nukleinowych. Utrwalanie komórek i tkanek oraz zatapianie w parafinie są dobrze znanymi przyczynami fragmentacji DNA i uporczywym problemem (patrz rysunki 1 i 2). W takich przypadkach nawet optymalna izolacja i oczyszczanie nie pomogą.
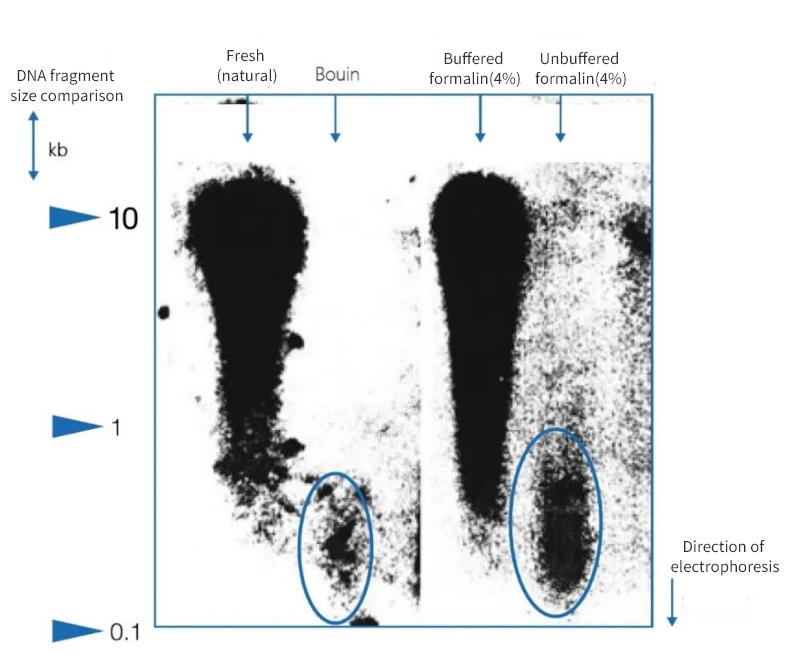
Rysunek 1 | Wpływ unieruchomienia na integralność DNA
Elektroforeza w żelu agarozowym wykazała, że jakość DNA wyizolowanego z parafinowych skrawków zwłok była bardzo zróżnicowana. W zależności od metody utrwalania, w ekstraktach obecne były fragmenty DNA o różnej średniej długości. DNA zachowało się tylko po utrwaleniu w natywnych, zamrożonych próbkach oraz w buforowanej, obojętnej formalinie. Zastosowanie silnie kwaśnego utrwalacza Bouina lub niebuforowanej formaliny zawierającej kwas mrówkowy spowodowało znaczną utratę DNA. Pozostała frakcja jest silnie pofragmentowana.
Po lewej stronie długość fragmentów wyrażona jest w kiloparach zasad (kbp)
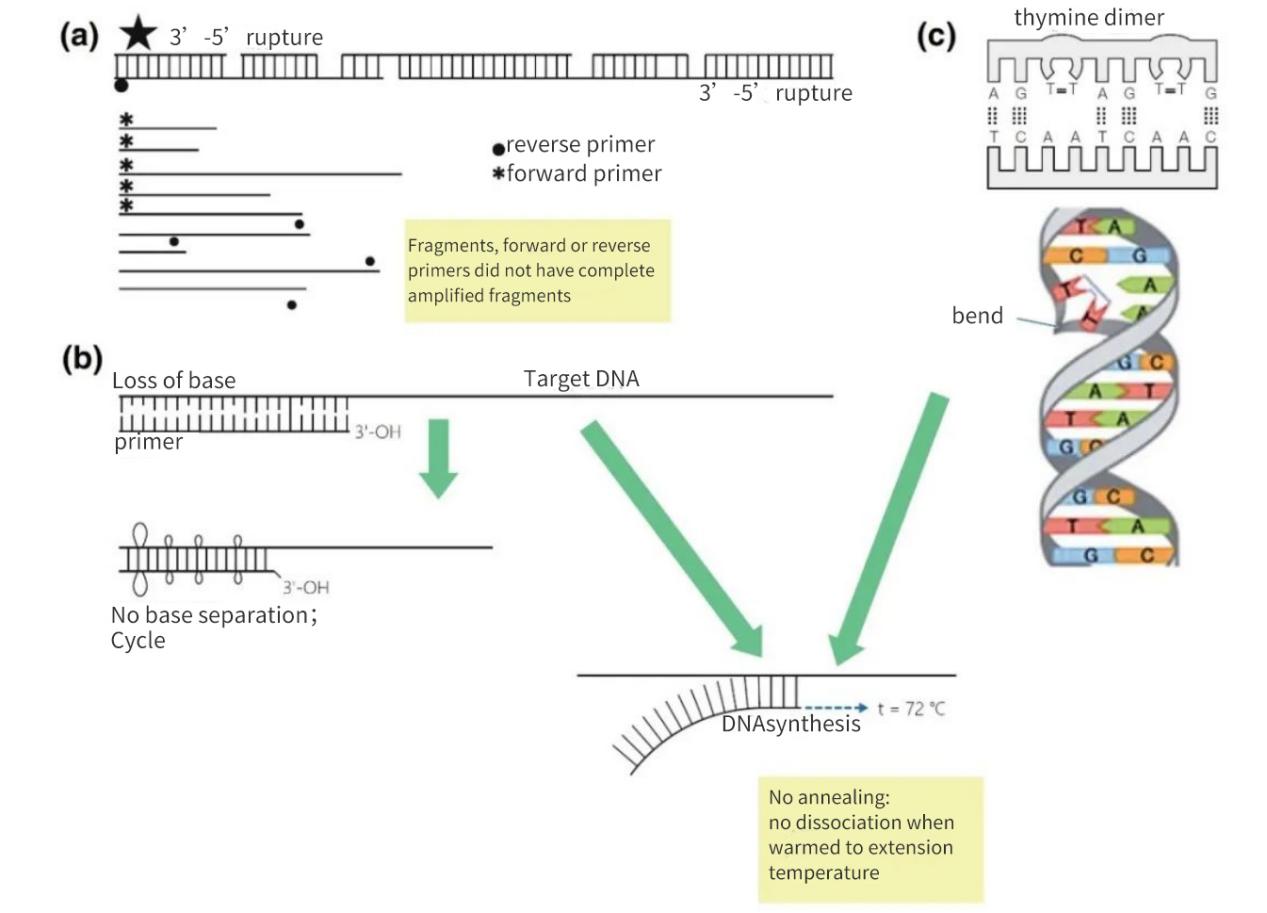
Rysunek 2 | Utrata integralności docelowych kwasów nukleinowych
(a) Przerwa 3′-5′ na obu niciach spowoduje pęknięcie docelowego DNA. Synteza DNA nadal będzie zachodzić na małym fragmencie. Jeśli jednak we fragmencie DNA brakuje miejsca hybrydyzacji startera, zachodzi jedynie amplifikacja liniowa. W najkorzystniejszym przypadku fragmenty mogą się wzajemnie nasycić, ale wydajność będzie niewielka i poniżej progu detekcji.
(b) Utrata zasad, głównie w wyniku depurynacji i tworzenia dimeru tymidyny, prowadzi do zmniejszenia liczby wiązań wodorowych i spadku Tm. Podczas wydłużonej fazy nagrzewania startery odłączą się od matrycy DNA i nie ulegną hybrydyzacji nawet w mniej rygorystycznych warunkach.
(c) Sąsiadujące zasady tyminowe tworzą dimer TT.
Innym częstym problemem, który często występuje w diagnostyce molekularnej, jest niższe niż optymalne uwalnianie docelowych kwasów nukleinowych w porównaniu z ekstrakcją fenolem i chloroformem. W skrajnych przypadkach może to prowadzić do wyników fałszywie ujemnych. Znaczną oszczędność czasu można uzyskać stosując lizę wrzącą lub enzymatyczną trawienie resztek komórkowych, jednak metoda ta często skutkuje niską czułością PCR z powodu niewystarczającego uwalniania kwasów nukleinowych.
Hamowanie aktywności polimerazy podczas amplifikacji
Ogólnie rzecz biorąc, inhibicja jest używana jako pojęcie zbiorcze opisujące wszystkie czynniki prowadzące do suboptymalnych wyników PCR. W sensie ściśle biochemicznym inhibicja ogranicza się do aktywności enzymu, tj. zmniejsza lub zapobiega konwersji substratu do produktu poprzez interakcję z miejscem aktywnym polimerazy DNA lub jej kofaktorem (np. Mg2+ w przypadku polimerazy DNA Taq).
Składniki próbki lub różnych buforów i ekstraktów zawierających odczynniki mogą bezpośrednio hamować enzym lub wychwytywać jego kofaktory (np. EDTA), inaktywując w ten sposób polimerazę i prowadząc do obniżenia jakości lub fałszywie ujemnych wyników PCR.
Jednak wiele interakcji między składnikami reakcji a kwasami nukleinowymi zawierającymi cząsteczki docelowe jest również określanych jako „inhibitory PCR”. Gdy integralność komórki zostanie naruszona przez izolację i kwas nukleinowy zostanie uwolniony, mogą wystąpić interakcje między próbką a otaczającym ją roztworem i fazą stałą. Na przykład, „zmiatacze” mogą wiązać jedno- lub dwuniciowe DNA poprzez oddziaływania niekowalencyjne i zakłócać izolację i oczyszczanie, zmniejszając liczbę cząsteczek docelowych, które ostatecznie docierają do naczynia reakcyjnego PCR.
Ogólnie rzecz biorąc, inhibitory PCR są obecne w większości płynów ustrojowych i odczynników stosowanych w klinicznych testach diagnostycznych (mocznik w moczu, hemoglobina i heparyna we krwi), suplementach diety (składniki organiczne, glikogen, tłuszcz, jony Ca2+) oraz składnikach środowiska (fenole, metale ciężkie).
| Inhibitory | Źródło |
| Jony wapnia | Mleko, tkanka kostna |
| Kolagen | Tkanka |
| Sole żółciowe | Kał |
| Hemoglobina | We krwi |
| Hemoglobina | Próbki krwi |
| Kwas huminowy | Gleba, roślina |
| Krew | Krew |
| Laktoferryna | Krew |
| (europejska) melanina | Skóra, włosy |
| Mioglobina | Tkanka mięśniowa |
| Polisacharydy | Roślina, odchody |
| Proteaza | Mleko |
| Mocznik | Mocz |
| Mukopolisacharyd | Chrząstka, błony śluzowe |
| Lignina, celuloza | Rośliny |
Bardziej rozpowszechnione inhibitory PCR można znaleźć w bakteriach i komórkach eukariotycznych, w DNA niebędącym celem, w makrocząsteczkach wiążących DNA w matrycach tkankowych oraz w sprzęcie laboratoryjnym, takim jak rękawiczki i tworzywa sztuczne. Preferowaną metodą usuwania inhibitorów PCR jest oczyszczanie kwasów nukleinowych podczas lub po ekstrakcji.
Obecnie różne zautomatyzowane urządzenia do ekstrakcji mogą zastąpić wiele protokołów ręcznych, ale nigdy nie osiągnięto 100% odzysku i/lub oczyszczenia cząsteczek docelowych. Potencjalne inhibitory mogą być nadal obecne w oczyszczonych kwasach nukleinowych lub mogły już zadziałać. Istnieją różne strategie ograniczania wpływu inhibitorów. Wybór odpowiedniej polimerazy może mieć znaczący wpływ na aktywność inhibitora. Inne sprawdzone metody ograniczania hamowania PCR to zwiększanie stężenia polimerazy lub stosowanie dodatków, takich jak BSA.
Zahamowanie reakcji PCR można wykazać stosując wewnętrzną kontrolę jakości procesu (IPC).
Należy starannie usunąć z izolatu kwasu nukleinowego wszystkie odczynniki i inne roztwory z zestawu do ekstrakcji, takie jak etanol, EDTA, CETAB, LiCl, GuSCN, SDS, izopropanol i fenol, poprzez dokładne płukanie. W zależności od stężenia mogą one aktywować lub hamować reakcję PCR.
Czas publikacji: 19 maja 2023 r.
 中文网站
中文网站