Niedawno JAMA Oncology (IF 33.012) opublikowało ważny wynik badań [1] zespołu prof. Cai Guo-ring ze Szpitala Onkologicznego Uniwersytetu Fudan i prof. Wang Jing ze Szpitala Renji Uniwersytetu Medycznego Jiao Tong w Szanghaju, we współpracy z KUNYUAN BIOLOGY: „Wczesne wykrywanie resztkowej choroby molekularnej i stratyfikacja ryzyka raka jelita grubego w stadium I do III poprzez metylację krążącego DNA guza i stratyfikację ryzyka” . To badanie jest pierwszym wieloośrodkowym badaniem na świecie, w którym zastosowano opartą na PCR technologię metylacji wielogenowej ctDNA krwi do przewidywania nawrotu raka jelita grubego i monitorowania nawrotu, zapewniając bardziej opłacalną ścieżkę techniczną i rozwiązanie w porównaniu z istniejącymi metodami technologii wykrywania MRD, co ma znacznie poprawić kliniczne zastosowanie przewidywania i monitorowania nawrotu raka jelita grubego oraz znacząco poprawić przeżywalność pacjentów i jakość życia. Badanie zostało również wysoko ocenione przez czasopismo i jego redaktorów, a także znalazło się na liście kluczowych artykułów rekomendowanych w tym numerze. Do jego recenzji zaproszono profesora Juana Ruiza-Bañobre z Hiszpanii i profesora Ajaya Goela ze Stanów Zjednoczonych. O badaniu poinformował również GenomeWeb, wiodący portal biomedyczny w Stanach Zjednoczonych.

Rak jelita grubego (CRC) jest częstym nowotworem złośliwym przewodu pokarmowego w Chinach. Dane Międzynarodowej Agencji Badań nad Rakiem (IARC) z 2020 r. pokazują, że 555 000 nowych przypadków w Chinach stanowi około 1/3 świata, a wskaźnik zapadalności awansował na drugie miejsce wśród częstych nowotworów w Chinach; 286 000 zgonów stanowi około 1/3 świata, co plasuje go na piątym miejscu wśród najczęstszych przyczyn zgonów z powodu raka w Chinach. Piąta przyczyna zgonów w Chinach. Warto zauważyć, że wśród zdiagnozowanych pacjentów, stadia TNM I, II, III i IV stanowią odpowiednio 18,6%, 42,5%, 30,7% i 8,2%. Ponad 80% pacjentów jest w środkowym i późnym stadium, a 44% z nich ma jednoczesne lub heterochroniczne przerzuty odległe do wątroby i płuc, które poważnie wpływają na okres przeżycia, zagrażają zdrowiu naszych mieszkańców i powodują duże obciążenie społeczne i ekonomiczne. Według statystyk Narodowego Centrum Onkologii, średni roczny wzrost kosztów leczenia raka jelita grubego w Chinach wynosi od 6,9% do 9,2%, a wydatki na opiekę zdrowotną pacjentów w ciągu roku od diagnozy mogą pochłonąć 60% dochodów rodziny. Pacjenci onkologiczni cierpią z powodu tej choroby i znajdują się pod dużą presją ekonomiczną [2].
Dziewięćdziesiąt procent zmian raka jelita grubego można usunąć chirurgicznie, a im wcześniej guz zostanie wykryty, tym wyższy pięcioletni wskaźnik przeżycia po radykalnej resekcji chirurgicznej, ale ogólny wskaźnik nawrotu po radykalnej resekcji nadal wynosi około 30%. Pięcioletnie wskaźniki przeżycia raka jelita grubego w populacji chińskiej wynoszą odpowiednio 90,1%, 72,6%, 53,8% i 10,4% w stadiach I, II, III i IV.
Minimalna choroba resztkowa (MRD) jest główną przyczyną nawrotu nowotworu po radykalnym leczeniu. W ostatnich latach technologia wykrywania MRD w guzach litych poczyniła duże postępy, a kilka szeroko zakrojonych badań obserwacyjnych i interwencyjnych potwierdziło, że pooperacyjny status MRD może wskazywać na ryzyko pooperacyjnego nawrotu raka jelita grubego. Badanie ctDNA ma tę zaletę, że jest nieinwazyjne, proste, szybkie, zapewnia dużą dostępność próbki i eliminuje heterogeniczność nowotworu.
Zarówno amerykańskie wytyczne NCCN dotyczące raka jelita grubego, jak i chińskie wytyczne CSCO dotyczące raka jelita grubego stanowią, że w przypadku określania ryzyka nawrotu pooperacyjnego i doboru chemioterapii adiuwantowej w raku jelita grubego, badanie ctDNA może dostarczyć informacji prognostycznych i predykcyjnych, wspomagających decyzje dotyczące leczenia adiuwantowego u pacjentów z rakiem jelita grubego w stadium II lub III. Jednak większość istniejących badań koncentruje się na mutacjach ctDNA w oparciu o technologię sekwencjonowania wysokoprzepustowego (NGS), która charakteryzuje się złożonością procesu, długim czasem realizacji i wysokimi kosztami [3], a także niewielkim stopniem uogólnienia i niską częstością występowania wśród pacjentów onkologicznych.
W przypadku pacjentów z rakiem jelita grubego w stadium III, dynamiczny monitoring ctDNA oparty na NGS kosztuje do 10 000 dolarów za pojedynczą wizytę i wymaga okresu oczekiwania do dwóch tygodni. Dzięki wielogenowemu testowi metylacji ColonAiQ®, który jest częścią tego badania, pacjenci mogą skorzystać z dynamicznego monitoringu ctDNA za jedną dziesiątą ceny i otrzymać raport w ciągu zaledwie dwóch dni.
Według 560 000 nowych przypadków raka jelita grubego w Chinach każdego roku, pacjenci kliniczni, głównie w stadium II-III raka jelita grubego (odsetek wynosi około 70%), mają pilniejszą potrzebę dynamicznego monitorowania, a wielkość rynku dynamicznego monitorowania MRD raka jelita grubego sięga milionów ludzi każdego roku.
Wyniki badań mają istotne znaczenie naukowe i praktyczne. Prospektywne badania kliniczne na dużą skalę potwierdziły, że technologia metylacji wielogenowej ctDNA z krwi oparta na PCR może być wykorzystywana do przewidywania i monitorowania nawrotów raka jelita grubego, zapewniając jednocześnie czułość, terminowość i opłacalność, co pozwala na lepsze wykorzystanie medycyny precyzyjnej w leczeniu większej liczby pacjentów onkologicznych. Badanie opiera się na ColonAiQ®, wielogenowym teście metylacji raka jelita grubego opracowanym przez KUNY, którego wartość kliniczna we wczesnym badaniu przesiewowym i diagnostyce została potwierdzona w centralnym badaniu klinicznym.
Gastroenterology (IF33.88), wiodące międzynarodowe czasopismo w dziedzinie chorób przewodu pokarmowego w 2021 r., opublikowało wyniki wieloośrodkowych badań szpitala Zhongshan Uniwersytetu Fudan, szpitala onkologicznego Uniwersytetu Fudan i innych renomowanych placówek medycznych, przeprowadzonych we współpracy z KUNYAN Biological, które potwierdziły doskonałą skuteczność ColonAiQ® ChangAiQ® we wczesnym badaniu przesiewowym i wczesnej diagnostyce raka jelita grubego, a także wstępnie zbadały jego potencjalne zastosowanie w monitorowaniu rokowania w raku jelita grubego.
Aby dodatkowo zweryfikować kliniczne zastosowanie metylacji ctDNA w stratyfikacji ryzyka, podejmowaniu decyzji dotyczących leczenia i monitorowaniu wczesnego nawrotu w raku jelita grubego w stadium I-III, zespół badawczy włączył do badania 299 pacjentów z rakiem jelita grubego w stadium I-III, którzy przeszli radykalną operację i pobrali próbki krwi w każdym punkcie kontrolnym (w odstępie trzech miesięcy) w ciągu jednego tygodnia przed operacją, jednego miesiąca po operacji oraz w pooperacyjnej terapii adiuwantowej w celu przeprowadzenia dynamicznego badania ctDNA we krwi.
Po pierwsze, stwierdzono, że badanie ctDNA może przewidzieć ryzyko nawrotu u pacjentów z rakiem jelita grubego wcześnie, zarówno przedoperacyjnie, jak i wcześnie po operacji. Pacjenci z dodatnim wynikiem ctDNA przed operacją mieli większe prawdopodobieństwo nawrotu pooperacyjnego niż pacjenci z ujemnym wynikiem ctDNA (22,0% > 4,7%). Wczesne pooperacyjne badanie ctDNA nadal przewidywało ryzyko nawrotu: miesiąc po radykalnej resekcji pacjenci z dodatnim wynikiem ctDNA byli 17,5 razy bardziej narażeni na nawrót niż pacjenci ujemni; zespół odkrył również, że połączone badanie ctDNA i CEA nieznacznie poprawiło skuteczność wykrywania nawrotu (AUC=0,849), ale różnica nie była istotna w porównaniu z badaniem samego ctDNA (AUC=0,839). Różnica nie była istotna w porównaniu z badaniem samego ctDNA (AUC=0,839).
Stopień zaawansowania klinicznego w połączeniu z czynnikami ryzyka jest obecnie główną podstawą stratyfikacji ryzyka pacjentów onkologicznych, a w obecnym paradygmacie duża liczba pacjentów nadal ma nawroty [4] i istnieje pilna potrzeba lepszych narzędzi stratyfikacji, ponieważ w klinice współistnieją nadmierne i niedostateczne leczenie. Na tej podstawie zespół sklasyfikował pacjentów z rakiem jelita grubego w stadium III do różnych podgrup na podstawie oceny ryzyka nawrotu klinicznego (wysokie ryzyko (T4/N2) i niskie ryzyko (T1-3N1)) oraz okresu leczenia adiuwantowego (3/6 miesięcy). Analiza wykazała, że pacjenci w podgrupie wysokiego ryzyka pacjentów z dodatnim wynikiem ctDNA mieli niższy wskaźnik nawrotu, jeśli otrzymali sześciomiesięczną terapię adiuwantową; w podgrupie niskiego ryzyka pacjentów z dodatnim wynikiem ctDNA nie było istotnej różnicy między cyklem leczenia adiuwantowego a wynikami leczenia pacjentów; podczas gdy u pacjentów z ujemnym wynikiem ctDNA rokowanie było znacznie lepsze niż u pacjentów z dodatnim wynikiem ctDNA, a okres bez nawrotu choroby (RFS) po operacji był dłuższy; rak jelita grubego w stadium I i stadium II o niskim ryzyku U żadnego pacjenta z ujemnym wynikiem ctDNA nie doszło do nawrotu w ciągu dwóch lat; w związku z tym oczekuje się, że integracja ctDNA z cechami klinicznymi pozwoli zoptymalizować stratyfikację ryzyka i lepiej przewidzieć nawrót.
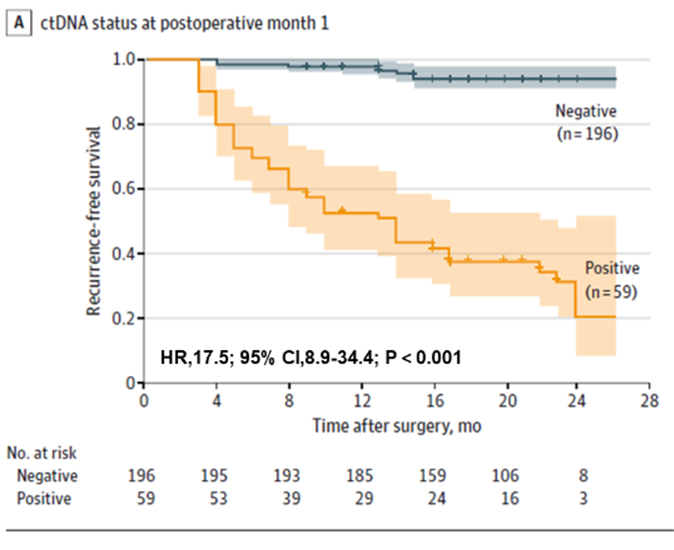
Rycina 1. Analiza ctDNA osocza w POM1 w celu wczesnego wykrywania nawrotu raka jelita grubego
Dalsze wyniki dynamicznego badania ctDNA wykazały, że ryzyko nawrotu było znacząco wyższe u pacjentów z dodatnim dynamicznym badaniem ctDNA niż u pacjentów z ujemnym wynikiem ctDNA w fazie monitorowania nawrotu choroby po ostatecznym leczeniu (po radykalnym zabiegu chirurgicznym + leczeniu adiuwantowym) (rycina 3ACD) oraz że ctDNA może wskazywać na nawrót guza nawet o 20 miesięcy wcześniej niż obrazowanie (rycina 3B), co daje możliwość wczesnego wykrycia nawrotu choroby i terminowej interwencji.
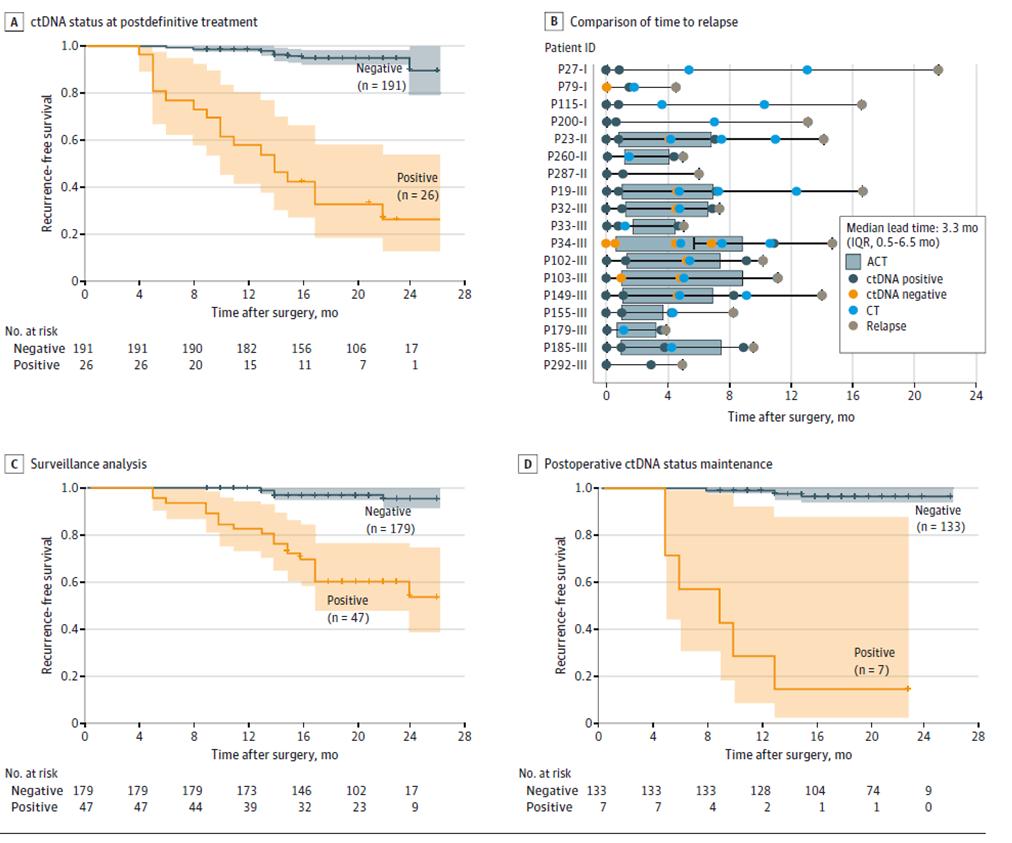
Rycina 2. Analiza ctDNA oparta na kohorcie longitudinalnej w celu wykrycia nawrotu raka jelita grubego
„Duża liczba badań medycyny translacyjnej nad rakiem jelita grubego jest wiodąca w tej dziedzinie, zwłaszcza badania MRD oparte na ctDNA wykazują duży potencjał poprawy pooperacyjnego leczenia pacjentów z rakiem jelita grubego, umożliwiając stratyfikację ryzyka nawrotu, wspomagając decyzje dotyczące leczenia i wczesne monitorowanie nawrotu.
Zaletą wyboru metylacji DNA jako nowego markera MRD w porównaniu z wykrywaniem mutacji jest to, że nie wymaga ona sekwencjonowania całego genomu tkanek nowotworowych, jest to, że jest bezpośrednio wykorzystywana do badań krwi i pozwala uniknąć fałszywie dodatnich wyników w przypadku wykrywania mutacji somatycznych pochodzących z tkanek normalnych, chorób łagodnych i hematopoezy klonalnej.
Badanie to oraz inne powiązane badania potwierdzają, że badanie MRD na podstawie ctDNA jest najważniejszym niezależnym czynnikiem ryzyka nawrotu raka jelita grubego w stadium I–III i może być pomocne w podejmowaniu decyzji dotyczących leczenia, w tym „eskalacji” i „obniżenia” terapii adiuwantowej. MRD jest najważniejszym niezależnym czynnikiem ryzyka nawrotu po operacji raka jelita grubego w stadium I–III.
Dziedzina MRD dynamicznie się rozwija, oferując szereg innowacyjnych, wysoce czułych i swoistych testów opartych na epigenetyce (metylacja DNA i fragmentomika) oraz genomice (ultragłębokie sekwencjonowanie ukierunkowane lub sekwencjonowanie całego genomu). Oczekujemy, że ColonAiQ® będzie nadal organizować badania kliniczne na dużą skalę i stanie się nowym wskaźnikiem badań MRD, łączącym dostępność, wysoką wydajność i przystępną cenę, a także będzie mógł być szeroko stosowany w rutynowej praktyce klinicznej.
Odniesienia
[1] Mo S, Ye L, Wang D, Han L, Zhou S, Wang H, Dai W, Wang Y, Luo W, Wang R, Xu Y, Cai S, Liu R, Wang Z, Cai G. Wczesne wykrywanie resztkowej choroby molekularnej i stratyfikacja ryzyka raka jelita grubego w stadium I–III poprzez metylację krążącego DNA guza. JAMA Oncol. 20 kwietnia 2023 r.
[2] „Obciążenie zachorowań na raka jelita grubego w populacji chińskiej: czy zmieniło się w ostatnich latach?”, Chinese Journal of Epidemiology, tom 41, nr 10, październik 2020 r.
[3] Tarazona N, Gimeno-Valiente F, Gambardella V i in. Sekwencjonowanie nowej generacji ukierunkowane na krążące DNA nowotworowe w celu śledzenia minimalnej choroby resztkowej w zlokalizowanym raku jelita grubego. Ann Oncol. 1 listopada 2019;30(11):1804-1812.
[4] Taieb J, André T, Auclin E. Udoskonalanie terapii adiuwantowej w przypadku raka jelita grubego bez przerzutów, nowe standardy i perspektywy. Cancer Treat Rev. 2019;75:1-11.
Czas publikacji: 28 kwietnia 2023 r.
 中文网站
中文网站